Man kann Methanol selbst herstellen, um die Energiedichte von grünem Wasserstoff zu erhöhen. Das spart kosten für teure Gasbehälter und Aufstellfläche, weil Methanol flüssig in üblichen Fässern gelagert werden kann. Wie sie Methanol selbst herstellen und wo Sie das CO2 dafür bekommen, erfahren Sie in diesem Kurzbericht von Tobias Jandt.
Inhalt
Biologisch Methanol selbst herstellen mit Wasserstoff 1
Biologische Methanisierung mit selbst erzeugtem Wasserstoff 1
Woher bekommt man CO2 zum Methanol herstellen. 1
2.1.3.1 CO zum Methanol selbst herstellen 2
Was kann man mit dem mit dem selbst hergestellten Methanol anfangen. 4
Welche Alternativen gibt es dazu, biologisch Methanol selbst herstellen zu wollen 4
Biologische Methanisierung mit selbst erzeugtem Wasserstoff
Bei der biologischen Methanisierung mit Wasserstoff werden die natürlichen Stoffwechselprozesse von Mikroorganismen genutzt, um das H 2 und CO 2 bzw. Kohlenstoffmonoxid CO, in Methan CH4 umzuwandeln. Bei den Mikroorganismen handelt es sich um Archaeen. Die Enzyme der Archaeen fungieren als Katalysator. Die Euryarchaeota, auch methanogene Archaeen genannt, spielen für den Methanisierungsprozess die größte Rolle. Sie lassen sich in drei Klassen unterteilen. Den Methanobacteria, Methanococci und Methanomicrobia. Für die verschiedenen Archaeen existieren verschiedene Temperaturoptima. Der mesophile Temperaturbereich reicht von 33-45 °C, der thermophile von 65-70 °C und der hyperthermophile von 65-85 °C. Der pH-Wert sollte sich im neutralen Bereich (zwischen 6,8 und 7,2) befinden. Der Prozess muss anaerob ablaufen, da die Archaeen obligat anaerob sind [18]. Die dabei auftretenden chemischen Reaktionen nennen sich Sabatier-Reaktionen und werden im Folgenden dargestellt [18].
|
4H + CO ↔ CH4 + 2 H O
|
(2.4) |
|
3H + CO ↔ CH4 + 2 H O |
(2.5) |
Zudem findet die Wassergas-Shift-Reaktion statt, welche den H 2 mit dem CO 2 zu Kohlenmonoxid CO und H 2O reagieren lässt.
H 2+ CO 2 ↔ CO + H 2O (2.6)
In der Literatur werden energetische Wirkungsgrade von biologischen Methanisierungsanlage von etwa 70 – 80 % angegeben [24], [25].
Woher bekommt man CO2 zum Methanol herstellen.
CO2-Quellen für Power to Gas (PtG)-Prozesse
Für die Umwandlung von Wasserstoff in Methan wird Kohlenstoffdioxid benötigt. Dieses kann auf verschiedene Weisen bereitgestellt werden. Da ein PtG-Prozess möglichst klimaneutral sein soll, sollte es sich bei dem verwendeten CO 2 um ein Produktgas handeln, welches sonst ungenutzt bliebe oder welches durch den Einsatz von überschüssiger, erneuerbarer, elektrischer Energie, gewonnen wurde [6].
Es existieren vier wesentliche CO 2-Quellen. So kann CO 2 aus Biogasaufbereitungsanlagen verwendet werden. Dort wird Biogas aus einer Biogasanlage, welches zu ca. 60 % aus Methan und 40 % aus CO 2 besteht, in Methan und CO 2 getrennt. Dieses CO 2 kann nun kostengünstig für den PtG-Prozess verwendet werden. Vor allem die Dezentralität von Biogasanlagen ist ein großer Vorteil [6], [26]. Außerdem kann das Biogas direkt mit dem Wasserstoff aus dem Elektrolyseverfahren in der Methanisierungsanlage vermengt werden. Im Produktstrom befände sich damit das Methan aus dem Biogas und das Methan, welches während der Reaktion entsteht [6], [26]. Auch die Nutzung von CO 2 aus Kraftwerks- oder Industrieanlagen ist eine Möglichkeit. In Zukunft werden bestimmte Industrieanlagen weiterhin mit fossilen Energieträgern betrieben. Dies garantiert eine CO -Emission, welche für ein Methanisierungsverfahren Verwendung finden könnte [6]. Die wohl naheliegendste Methode ist das CO 2-Recycling, auch Oxyfuel-Verfahren genannt. Dabei würde das entstehende CO bei der Verbrennung des erzeugten Methans, der Methanisierung zugefügt werden [6]. Letztlich ist auch die Nutzung des CO aus der Atmosphäre möglich. Dabei gibt es vier verschiedene Verfahren. Die Adsorption an Feststoffen, die Absorption in Flüssigkeiten, die Kondensation in kryogenen Prozessen und die Abscheidung mittels Membranen [6].
Am TEC wird die Methode der Adsorption und Desorption mittels einer Direct Air Capture-Anlage (DAC-Anlage) von der Firma Climeworks realisiert. Deshalb wird im folgenden Kapitel näher auf deren Konzept eingegangen.
2.1.3.1 CO zum Methanol selbst herstellen
Das Konzept der DAC-Anlage der Firma Climeworks
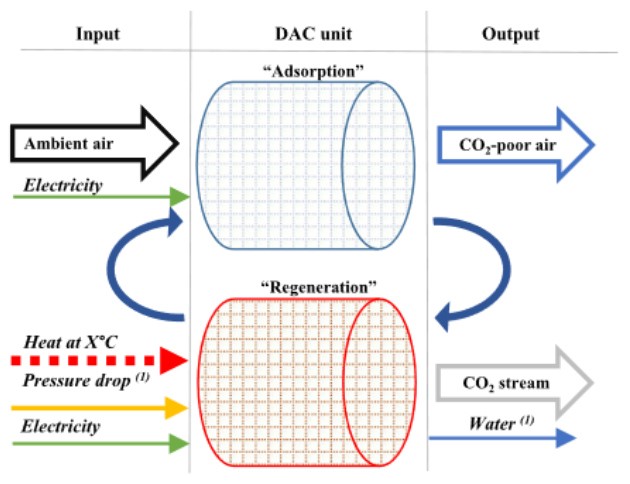
Die DAC-Anlage der Firma Climeworks besteht im Wesentlichen aus einem Ventilator auf dessen Gegenseite sich ein schließbares Ventil befindet. Im Inneren der Anlage ist ein Adsorptionsmittel, welches aus Zellulosefaser (NFC) besteht und mit Aminen (AEAPDMS) besetzt ist. Die Amine dienen als Sorbens und sorgen für die Adsorption des CO . Sie bieten sich als Sorbens an, da sie fast ausschließlich mit CO reagieren. Dadurch wird eine hohe Reinheit des Produktgases gewährleistet [27], [28].
Im ersten Schritt eines Anlagenzyklus wird der Ventilator betrieben, welcher die Umgebungsluft in die Kammer der DAC-Anlage befördert. Dabei wird elektrische Energie umgesetzt. Der
Energiebedarf beträgt dabei 0,2 bis 0,3 kWh/kg CO2. Wenn die Luft durch die Kammer strömt, trifft sie auf das NFC-AEAPDMS-Sorbens. Die Amine adsorbieren das CO , sowie Wasserdampf aus der Umgebungsluft. Die Adsorption ist eine exotherme Reaktion, deren Bindungsenthalpie bei −0,354 kWh/kg CO2 liegt. Die dabei auftretende chemische Reaktion sieht folgendermaßen aus:
CO 2+ 2 RNH 2 ↔ RNHCOO,- + RNH3+ (2.7)
Durch Chemiesorption wird ein CO -Molekül an zwei RNH -Molekülen, welche die Amine repräsentieren, gebunden. Dabei wird Carbamat (RNHCOO,) und Ammoniak (RNHM*) gebildet
[28].
Neben der Art des Sorbens, hängt die Menge an adsorbierten CO , von der Adsorptionsdauer ab.
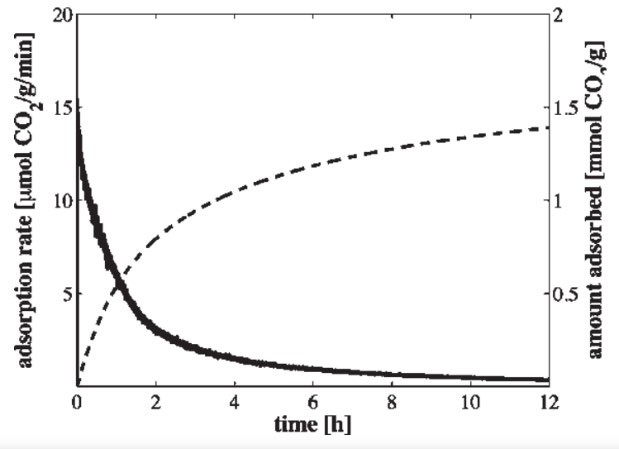
In Abbildung 6 wird das Adsorptionsverhalten von AEAPDMS gezeigt. Es ist erkennbar, dass je

Abbildung
6:
Menge des adsorbierten CO
2
am AEAPDMS
in Abhängigkeit zu Adsorptionsdauer

Abbildung
7:
Menge des adsorbierten CO
2
am AEAPDMS
in Abhängigkeit zur Adsorptionsdauer
8
Grundlagen
länger die Adsorption stattfindet, die Adsorptionsrate exponentiell sinkt. Deshalb ist es sinnvoll die Adsorption nach etwa zwei Stunden zu beenden, da dann die Halbwertszeit erreicht ist. Neben dem CO wird auch ein kleiner Anteil an Wasserdampf H O gebunden [28].
Im zweiten Schritt wird der Ventilator abgeschaltet und die Kammer über Ventile luftdicht abgeschlossen. Zudem wird die restliche vorhandene Luft abgepumpt. Die Adsorption ist damit beendet [9], [10].
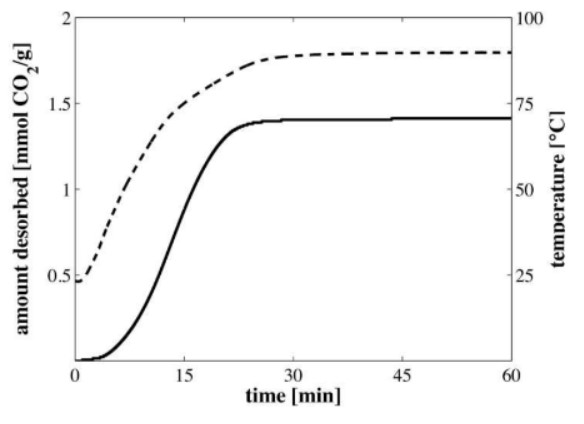
Im dritten Schritt findet die Desorption statt. Hier wird dem System thermische Energie hinzugefügt und gleichzeitig der Druck verringert. Das Ziel dabei ist, das CO und das Wasser von dem Sorbens zu lösen. Dabei wird die Kammer auf bis zu 100°C erwärmt, wobei die chemischen Bindungen zwischen CO bzw.
dem
I

Abbildung
8:
Zyklus der DAC-Anlage [19]
Wasser und dem Sorbens getrennt wird.
Wie in Abbildung 7 zu sehen, beträgt die Dauer für diesen Prozess etwa 20 bis 30
Minuten. Die nötige thermische Energie
;F6 für die Desorption liegt bei 1,5 bis 2 ;- GH [27]–[29].
Nach der Desorption ist das Sorbens wieder frei von CO 2 und Wasser und der Prozess kann von Neuem beginnen. Das CO 2 wird zwischengespeichert und hat eine Reinheit von 99,9% [28], [29].
In Abbildung 8 wird das Schema eines Adsorptions- und Desorptionszyklus visualisiert.
In einer Studie der University of California, welche sich mit dem aktuellen Stand der Technik der
DAC-Technologie beschäftigt hat, wird ein theoretischer Energiebedarf des Adsorptionsprozesses
;F6 von etwa 0,24 bis 0,64 kWh/kg CO2beschrieben. Der Desorptionsprozess wird mit einem Bedarf von
0,94 bis 1,33 kWh/kg CO2beschrieben [30]. In einer weiteren Studie des Imperial College London, welche sich mit den verschiedenen Sorbens der DAC-Anlage beschäftigt hat, wird ein elektrischer
Energiebedarf von 0,2 kWh/kg CO2 und ein thermischer Energiebedarf von 1,5 – 2 kWh/kg CO2 beschrieben
[31]. Die Abbildung 9 zeigt, dass für einen DAC-Prozess ein Prozesswirkungsgrad von ca. 5 % realistisch ist. Damit ist die DAC-Technologie die ineffizienteste Technologie der CO -Gewinnung.
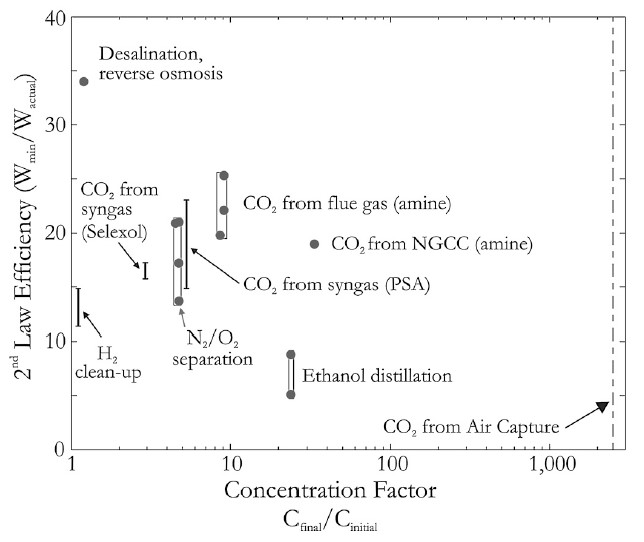
Abbildung 9: Wirkungsgrad von verschiedenen CO2-Filter-Systemen [32]
Was kann man mit dem mit dem selbst hergestellten Methanol anfangen.
Es gibt Methanol Brennstoffzellen von Efoy z.B.
Methanol Autos für diejenigen, die es sich leisten können, aber auch Blockheizkraftwerke und Motoren, die mit selbst hergestellten Methanol Strom und Wärme erzeugen können, sind gängige Verbraucher.
Welche Alternativen gibt es dazu, biologisch Methanol selbst herstellen zu wollen
Wer Methanol selbst herstellen aus Platzgründen, eher chemisch anstrebt, kann auf die Methanol-Synthese zurückgreifen. Schauen Sie sich gerne dieses Video über die Methanol Synthese an. In nur 1 Min. sehen Sie alle Komponenten, um Methanol selbst herstellen zu können.
Videos werden nur für Mitglieder angezeigt.
Unterstützen Sie unsere Arbeit mit einer Mitgliedschaft. Vielen Dank!
Videos are only displayed for members.
Support our work by becoming a member. Thank you!
Les videos sont seulement visible pour les membres. Soutenez-nous en devenant membre. Merci beaucoup!
and check electrolyzer cost of more than 60 hydrogen manufacturers to see our best value